Infektio aktuell 2022
Abkürzungen in der medizinischen Literatur
Falls Sie sich auch gelegentlich über zu viele Abkürzungen in wissenschaftlichen Publikationen wundern, gefällt Ihnen sicher der folgende Leserbrief eines Kollegen aus der onkologischen Radiologie in Santa Cruz, Kalifornien, an den Herausgeber des New England Journal of Medicine. Die Zeilen sind mittlerweile 30 Jahre alt, aber trotzdem unverändert aktuell.
Abbreviations in the Medical Literature
There is a recent trend (RT) in the medical literature (ML) to abbreviate previously unabbreviated phrases for the sake of efficiency (PUPSAE). Although it makes good sense (GS), the frequency with which it is used can tax the inexperienced reader (IR). Sometimes repetition can actually be beneficial (RCABB) by allowing the reader to retain words he does not constantly have to refer back to (WOHCREPT). I would like to suggest to the editor (ED), that for the IR who doesn't wish to have PUPSAE, he have the GS to change the ML so that RCABB and he can eliminate WOHCREBT.
Letter to the Editor, N Engl J Med 1989; 320: 1152
(PubMed) (gekürzt)
****
Dezember 2022
Therapeutisches Drug Monitoring bei Behandlung mit ß-Laktamantibiotika
Penicilline, Cephalosporine und Carbapeneme gehören zu den häufig angewandten Antibiotika. Obwohl sie seit vielen Jahrzehnten im Einsatz sind, gibt es durchaus noch offene Fragen hinsichtlich ihrer
optimalen Dosierung.
Die Plasmakonzentrationen von ß-Laktamantibiotika sollten über eine möglichst langen Zeitraum oberhalb der minimalen Hemmkonzentration der Erreger liegen. Dieses Ziel hat für ß-Laktamantibiotika
eindeutig eine höhere Bedeutung, als kurzfristig erreichbare hohe Spitzenspiegel. Die Spiegel der Antibiotika unterliegen hohen interindividuellen Schwankungen, da Nierenfunktion, Verteilungsvolumen
und andere physiologische Parameter durch die Infektion je nach Schweregrad unterschiedlich beeinflusst werden. Da die Konzentrationen der Penicilline, Cephalosporine und Carbapeneme im Plasma eines
Patienten nicht exakt vorhersehbar sind, erscheint ein therapeutisches Drug Monitoring sinnvoll.
Mehr dazu in der aktuellen Ausgabe der Zeitschrift für Infektionstherapie
Heft 6.2022 jetzt im Onlineshop bestellen
8. Dezember 2022
Liebe Leserinnen, liebe Leser,
seit mehr als vier Jahrzehnten habe ich in diversen Funktionen für die Zeitschrift für Infektionstherapie gearbeitet, in den letzten Jahren als Herausgeber an der Seite von Professor Hartmut Lode und Professor Mathias Pletz. Die Arbeit hat mir stets sehr große Freude gemacht und ich habe insbesondere mit meinen Beiträgen für „Infektio Aktuell / Infektio Newsletter“ versucht, Sie aktuell und zielgerichtet über die neuesten Entwicklungen im Bereich der Infektiologie zu informieren. Leider muss ich aus gesundheitlichen Gründen zum Jahresende meine Aktivitäten für die Zeitschrift einstellen. Ich wünsche meinen Mitherausgebern und dem gesamten Team eine glückliche Hand und gutes Gelingen auch in den nächsten Jahrzehnten mit der Zeitschrift für Infektionstherapie.
Mit herzlichen kollegialen Grüßen
Ihr
Ralf Stahlmann
November 2022
14. November 2022
Orale Therapie mit dem COVID-19-Präparat Paxlovid®: wirksam, gut verträglich aber zurückhaltend eingesetzt.
Zu Beginn der Pandemie erschien es als ferne Zukunftsvision: ein antiviral wirksames Medikament zur oralen ambulanten Therapie, das bei rechtzeitiger Gabe in der Lage ist, schwere Verläufe einer SARS-CoV-2-Infektion zu verhindern. Mittlerweile ist Paxlovid® - das Kombinationspräparat aus Nirmatrelvir und Ritonavir - zur Behandlung von COVID-19-Risikopatienten seit fast einem Jahr in der EU zugelassen. Es soll zur Behandlung von symptomatischen, nicht hospitalisierten Patienten mit COVID-19 ohne zusätzlichen Sauerstoffbedarf und erhöhtem Risiko für einen schweren Krankheitsverlauf eingesetzt werden. Die Einnahme muss möglichst innerhalb von fünf Tagen nach Beginn der Symptome erfolgen, Hausärztinnen und Hausärzte können die Tabletten direkt an ihre Patienten abgeben.
Interaktionen mit anderen Arzneistoffen müssen beachtet werden. Hinweise dazu bietet eine Übersicht der Fachgruppe COVRIIN am Robert Koch-Institut. Auch bei Patienten mit stark eingeschränkter Nieren- und Leberfunktion sollte das Präparat nicht angewandt werden.
Übersicht und Empfehlungen der Fachgruppe COVRIIN
7. November 2022
Das Netzwerk Junge Infektionsmedizin (jUNITE)
„Riskiere einen Blick über den eigenen Tellerrand. Lerne Kolleginnen und Kollegen aus anderen Fachgebieten kennen!“ Unter diesem Motto wirbt das Netzwerk Junge Infektionsmedizin (jUNITE) um Aufmerksamkeit. Das Ziel ist klar definiert: junge Kolleginnen und Kollegen, die klinisch oder wissenschaftlich in der Infektionsmedizin tätig sind, sollen sich früh vernetzen. Auf diesem Weg will jUNITE Möglichkeiten des Austausches bieten, um wissenschaftliche Kooperation zu fördern und bereits frühzeitig ein Verständnis für andere Bereiche der Infektionsmedizin zu generieren.
Ein Besuch der Website lohnt sich für alle, die mehr über die zahlreichen Aktivitäten des Netzwerkes erfahren möchten:
Aktuell hat das Netzwerk eine anonyme Online-Befragung zum Thema „Diagnostic Stewardship gegen antimikrobielle Resistenzen (AMR)“ erstellt mit dem Ziel, Erregerdiagnostik in der Anforderung und Bearbeitung zu verbessern. Hierbei geht es nicht um COVID-19 und auch nicht um Affenpocken, sondern um die Zunahme multiresistenter Erreger weltweit. Weitere Details finden Sie auch in dem Beitrag im Deutschen Ärzteblatt in dem über die Initiative berichtet wurde.
Oktober 2022
31. Oktober 2022
Rationale Diagnostik und Therapie von Fußinfektionen bei Diabetespatienten
Das diabetische Fußsyndrom ist eine häufige Komplikation bei Diabetes mellitus. Insbesondere die Osteomyelitis des Fußes stellt eine gefürchtete Komplikation dar, weil sie das Risiko für Amputationen erhöht. Die aseptisch gewonnene Knochenbiopsie mit histologischer und mikrobiologischer Aufarbeitung gilt als optimale Diagnostik. In Chicago, USA, wurden die Daten von insgesamt 152 Diabetes-Patienten mit einer Osteomyelitis retrospektiv ausgewertet. Die wesentliche Frage war, inwiefern eine exakte Diagnostik zu einer optimierten Antibiotikatherapie führen kann. Mikrobiologisch auswertbare Proben lagen aus tieferen Gewebeabschnitten vor, sowie von 29 Knochenbiopsien, insgesamt 70 Bakterienkulturen wurden angelegt. Häufig lag eine polymikrobielle Infektion vor, in 36 Kulturen ließen sich grampositive Erreger nachweisen, in 19 gramnegative Bakterien. Bei 41 Patienten wurde die Therapie angepasst, überwiegend handelte es sich um einen Wechsel zu einem Antibiotikum mit schmalerem Spektrum (29 Patienten, 62%), nur bei vier Patienten (9%). musste zu einem Antibiotikum mit breiterem Spektrum gewechselt werden, weil die empirisch eingesetzte Substanz die nachgewiesenen Erreger nicht erfasste. Einige methodische Einschränkungen müssen bedacht werden: bei den meisten Patienten (81%) wurden die Proben zur mikrobiologischen Diagnostik während der Amputation gewonnen. Es kann angenommen werden, dass die Proben also von Patienten mit einem schwerwiegenden Verlauf stammen. Da es ich um eine retrospektive Studie mit begrenzter Patientenzahl handelt, sind prospektive Studien notwendig, um das Ergebnis zu überprüfen.
31. Oktober 2022
Dauer der Antibiotikatherapie bei Patienten mit vertebraler Osteomyelitis
Die optimale Dauer der Antibiotikabehandlung bei hämatogener vertebraler Osteomyelitis sollte sich nach dem Rezidivrisiko des Patienten richten, sie ist bisher jedoch nicht eindeutig festgelegt. In einer retrospektiven Studie wurde die optimale Dauer der Antibiotikabehandlung bei Patienten mit einem niedrigen oder hohen Rezidivrisiko ermittelt. Bei insgesamt 314 Patienten mit mikrobiologisch bestätigter vertebraler Osteomyelitis konnte ein Rezidiv festgestellt werden. Methicillin-resistente Staphylococcus-aureus-Infektionen, nicht drainierte paravertebrale / psoasale Abszesse und terminale Niereninsuffizienz erwiesen sich als unabhängige Risikofaktoren für ein Wiederauftreten. Dementsprechend wurden 60,8% als Patienten mit niedrigem Risiko und 39,2% als Patienten mit hohem Risiko eingestuft. Bei den Hochrisikopatienten zeigte sich ein signifikanter Abwärtstrend der Rezidivrate je nach Gesamtdauer der Antibiotikatherapie: ca. 35 % (vier bis sechs Wochen), ca. 30 % (sechs bis acht Wochen) und etwa 10 % (acht Wochen und mehr). Bei Patienten mit niedrigem Risiko war dieser Zusammenhang immer noch signifikant, aber die Rezidivraten waren in den drei Zeiträumen mit 12%, 6% und 2 % deutlich niedriger. Eine Antibiotikatherapie sollte bei Patienten mit hämatogener vertebraler Osteomyelitis und einem hohen Rezidivrisiko für mindestens acht Wochen erfolgen. Bei Patienten mit geringem Risiko kann eine kürzere Dauer von sechs bis acht Wochen einer auf den Erreger ausgerichteten Antibiotikatherapie ausreichend sein.
13. Oktober 2022
Aktuelle Ausgabe (Heft 5, 2022) Übersicht:
„Antibiotic Stewardship – Strukturen und Praxis“
Im Spannungsfeld zwischen der Ausbreitung multiresistenter bakterieller Erreger und dem Mangel an neuen Antibiotika wird der rationale Umgang mit Antiinfektiva zunehmend wichtig. Resistenzentwicklung ist bakterielle Evolution und kann nicht vermieden, wohl aber durch einen umsichtigen Einsatz verzögert werden. Antibiotic-Stewardship (ABS)-Programme haben genau dieses Ziel. Die zunehmende Verfügbarkeit einer schnelleren mikrobiologischen Diagnostik und Resistenztestung ermöglicht eine frühere zielgerichtete Therapie. So können das Therapieergebnis und der Antibiotikaverbrauch optimiert werden. Ebenso wird die vermehrte Ausbildung von Ärzten im Bereich Infektiologie zu einer Verbesserung der Behandlungsqualität beitragen.
Den Übersichtsartikel der Autoren Anette Friedrichs, Evelyn Kramme, Sebastian Weis und Mathias Pletz zu diesem Thema lesen Sie in der aktuellen Ausgabe der Zeitschrift für Infektionstherapie (Heft 5, 2022). Die in dem Beitrag zitierte Literatur sowie eine Abbildung „Rationale Antibiotikatherapie“ (PDF) finden Sie hier.
Heft 5.2022 jetzt im Onlineshop bestellen
September 2022
26. September 2022
Neuer Antikörper bei Infektionen mit dem RS-Virus
Mit Nirsevimab (BEYFORTUS) wurde von der EMA Mitte September ein monoklonaler Antikörper für die Zulassung empfohlen, der gegen das RS-Virus gerichtet ist. Der rekombinante humane IgG1-Antikörper bindet an Untereinheiten des Fusionsproteins des Virus und verhindert dadurch seinen Eintritt in die Zelle. Die Wirkdauer beträgt mehrere Monate. In der Zellkultur ist Nirsevimab vielfach potenter als das ähnlich wirksame Palivizumab (SYNAGIS), das monatlich injiziert werden muss. Eine einmalige Injektion von Nirsevimab, die vor der RSV-Saison verabreicht wurde, schützt vor RSV-Infektionen der unteren Atemwege (s. Infektio Aktuell, 9. April 2022). Die Zulassung in der Europäischen Union wird für November erwartet. Es bleibt abzuwarten, ob die Fachgesellschaft (DGPI) und die STIKO den Einsatz nicht nur für Säuglinge mit Risikofaktoren, sondern auch für gesunde Säuglinge empfehlen.
26. September 2022
Nomenklatur der monoklonalen Antikörper – es wird differenzierter!
Anfang 2022 waren mehr als 100 verschiedene monoklonale Antikörper (monoclonal antibodies) als Arzneimittel auf dem deutschen Markt. Über drei Jahrzehnte lang waren sie an der Endung „-mab“ im INN erkennbar. Der International Nonproprietary Name (INN) ist ein weltweit eindeutig mit der Struktur eines Wirkstoffs verknüpfter Name. Da zahlreiche weitere monoklonale Antikörper in der Entwicklung sind, wird es zunehmend schwieriger, neue unverwechselbare INN festzulegen. Eine WHO-Expertengruppe beschloss daher, eine neue, differenziertere Nomenklatur für monoklonale Antikörper zu entwickeln. Das neue Schema verzichtet auf die Nutzung des Stammsuffixes -mab und teilt die monoklonalen Antikörper auf vier neue Stämme ein:
1. -tug für nicht modifizierte Immunglobuline („unmodified immunoglobulins“)
2. -bart für künstliche Immunglobuline („artificial immunoglobulins“)
3. -ment für Immunglobulin-Fragmente („immunoglobulin fragments“)
4. -mig für multispezifische Immunglobuline („multi-specific immunoglobulins“)
Die neuen Regeln gelten ab 2023, bereits vergebene Namen für monoklonale Antikörper werden nicht geändert.
20. September 2022
28. Jahrestagung der PEG 2022 am 7. / 8. Oktober 2022
Am Freitag, 7. Oktober 2022, um 13:00 Uhr beginnt die Jahrestagung der Paul-Ehrlich-Gesellschaft für Infektions-therapie e.V.. Sie findet als virtuelle Tagung statt.
Teilnahmegebühr beträgt 30 € für Mitglieder der PEG (50 € für Nicht-Mitglieder)
Studenten können für 15 € teilnehmen.
Das ausführliche Programm finden Sie hier.
Die Veranstaltung wird am Freitag, 7. Oktober mit folgenden Beiträgen eröffnet:
13:15 – 13:40 Uhr
Update Clostridioides difficile Erkrankungen
Christina Bahrs, Jena
13:40 – 14:05 Uhr
Chinolone – zu Unrecht verrufen
Florian Thalhammer, Wien
14:05 – 14:30 Uhr
Antibakterielle Kombinationstherapien – wirkt mehr besser?
Matthias Vossen, Wien
Am Samstag, 8. Oktober, stehen zunächst Themen zur antimykotischen Therapie im Vordergrund
08:40 – 09:05 Uhr
Resistenz bei Pilzen: Aktuelle Trends
Oliver Kurzai, Würzburg und Jena (angefragt)
09:05 – 09:30 Uhr
Neue Antimykotika: Was kommt in die Klinik?
Oliver Cornely, Köln
Aus der Sektion „Grundlagen“ kommen die folgenden Beiträge:
11:35 – 12:00 Uhr
PEG-Resistenzstudie 2019 – what’s new?
Michael Kresken, Bonn
12:00 – 12:25 Uhr
Staphylococcus aureus wird „komplex“ - die neuen Spezies und deren klinische Bedeutung
Karsten Becker, Greifswald
12:25 – 12:50 Uhr
Model-Informed Precision Dosing von Antibiotika
Iris Minichmayr, Uppsala
Mit einer aktuellen Bestandsaufnahme zum Thema COVID wird die Jahrestagung beendet
13:05 – 13:30 Uhr
Aktueller Stand Epidemiologie und Impfempfehlungen
Osamah Hamouda, Berlin (angefragt)
13:30 – 13:55 Uhr
Aktueller Stand der antiviralen Therapie
Björn Jensen, Düsseldorf
13:55 – 14:20 Uhr
Intensivmedizinisches Management und Sekundärkomplikationen
Timo Brandenburger, Düsseldorf
Integrierte Firmensymposien ergänzen das Programm
Freitag, 16:00 – 17:00 Uhr (Pfizer)
Spezielle Herausforderungen bei der antibiotischen und antimykotischen Therapie
schwerer Infektionen anhand klinischer Beispiele
Tim Rahmel, Bochum
Samstag, 10:15 – 11:15 Uhr (MSD)
Multiresistente Gram-negative Erreger: Neue Therapien, neue Probleme?
Hartmuth Nowak, Bochum
Frühe antivirale COVID-19-Therapien: Gamechanger oder Ladenhüter?
Nils von Hentig, Frankfurt a. M.
Paul-Ehrlich-Gesellschaft für Infektionstherapie e. V.
https://www.p-e-g.org/
16. September 2022
Maribavir –
eine neue Therapieoption bei CMV-Infektionen
Mehrere Virustatika stehen zur Therapie einer Infektion mit dem Cytomegalievirus (CMV) zur Verfügung. Allerdings verursachen sie relativ häufig unerwünschte Wirkungen, so dass ein Bedarf für besser verträgliche Substanzen besteht. Das CHMP (EMA) hat grünes Licht für die Zulassung von Maribavir (LIVTENCITY) gegeben, das bei CMV-Infektionen eingesetzt werden kann, wenn eine andere Behandlung mit Wirkstoffen, wie Ganciclovir, Foscarnet oder Cidofovir, bei Patienten nach einer Organtransplantation oder Stammzelltransplantation unwirksam war.1 In einer Phase-3-Studie mit 352 Patienten war es therapeutisch überlegen und besser verträglich als Forcarnet oder Ganciclovir / Valganciclovir. Während die Therapie mit den Standardmedikamenten bei fast jedem dritten Patienten wegen Unverträglichkeit abgebrochen werden musste, war dies nur bei 13% der Maribavir-Behandelten der Fall.2
1. EMA / CHMP. Summary of opinion Livtencity (Maribavir). September 15, 2022
12. September 2022
Neue Leitlinie “Tuberkulose im Erwachsenenalter“
Fünf Jahre nach der Erstveröffentlichung liegt eine neue Version der S2k-Leitlinie „Tuberkulose im Erwachsenenalter“ vor (AWMF).
Herausgeber sind das
Deutsche Zentralkomitee zur Bekämpfung der Tuberkulose e.V. (DZK)
und die
Deutsche Gesellschaft für Pneumologie und Beatmungs-medizin e.V. (DGP).
Weltweit ist die Tuberkulose eine der häufigsten Infektionserkrankungen mit circa 10 Millionen Neuerkrankungen/Jahr. Trotz der niedrigen Inzidenz in Deutschland bleibt Tuberkulose auch hier eine wichtige Differentialdiagnose. Es besteht, unter anderem aufgrund der abnehmenden klinischen Erfahrung, ein Informationsbedarf zu allen Aspekten der Tuberkulose und ihrer Kontrolle. Die aktualisierte S2k-Leitlinie „Tuberkulose im Erwachsenenalter“ umfasst die mikrobiologische Diagnostik, die Grundprinzipien der Standardtherapie, die Behandlung verschiedener Organmanifestationen, den Umgang mit typischen unerwünschten Arzneimittelwirkungen, die Besonderheiten in der Diagnostik und Therapie resistenter Tuberkulose, sowie die Behandlung bei TB-HIV-Koinfektion. Sie soll dabei helfen, den heutigen Herausforderungen im Umgang mit Tuberkulose in Deutschland gewachsen zu sein.
Standardtherapie der Tuberkulose
Unter Berücksichtigung der für Deutschland bekannten Resistenzsituation wird für Patienten ohne Risikofaktoren für eine Resistenz entsprechend den Leitlinien der Weltgesundheitsorganisation (WHO) und anderen internationalen Empfehlungen eine initiale Vierfachtherapie mit den Medikamenten der Standardtherapie Isoniazid (INH), Rifampicin (RMP), Pyrazinamid (PZA) und Ethambutol (EMB) über zwei Monate (Initialphase) empfohlen. In der Kontinuitätsphase der Therapie sollen INH und RMP über weitere vier Monate bis zum Abschluss der sechsmonatigen Gesamttherapiedauer gegeben werden.
Kurzzeittherapie?
Die WHO sieht die Möglichkeit als gegeben an, die Standardtherapie mit den Medikamenten Rifapentin, Isoniazid, Pyrazinamid und Moxifloxacin – täglich verabreicht über 4 Monate – durchzuführen. Da Rifapentin in Deutschland nicht verfügbar ist, wird die 4-monatige Kurzzeittherapie zum jetzigen Zeitpunkt nicht empfohlen.
Initiale Dreifachtherapie?
Die Gabe von nur drei Medikamenten (INH, RMP, PZA) in der Initialphase wird für Erwachsene nicht mehr empfohlen. Die große Gefahr einer initialen Dreifachtherapie mit INH, RMP und PZA liegt vor allem in einer nicht bekannten INH-Resistenz, da in einem solchen Fall wegen der Unwirksamkeit des PZA im nicht-sauren pH-Milieu de facto eine RMP-Monotherapie verabreicht wird, die in großen Erregerpopulationen zu einer Selektion RMP-resistenter Mutationen führen kann. Eine solche Selektion kann durch EMB als viertes Medikament verhindert werden.
Tuberkulose im Erwachsenenalter, PDF der Langfassung, 3,6 MB
Epidemiologie der Tuberkulose in Deutschland
(RKI Bericht 2021)
►Mit insgesamt 4.127 Tuberkulose-Fällen (5,0 Neuerkrankungen pro 100.000 Einwohner) wurden im Jahr 2020 die niedrigsten Zahlen seit Einführung des Infektionsschutzgesetzes (IfSG) registriert.
►Männer erkranken häufiger an einer Tuberkulose als Frauen (Inzidenz 6,5 bzw. 3,5 pro 100.000). Die höchste Inzidenz wurde bei jungen Erwachsenen in der Altersgruppe der 20- bis 24-Jährigen registriert (11,4 pro 100.000).
►Die Lunge war mit einem Anteil von 71,4% (2.903 Fälle; Inzidenz 3,5) das am häufigsten betroffene Organ. Die infektiöse, offene Lungentuberkulose war deutlich häufiger als die geschlossene (2.495 bzw. 408 Fälle).
►Der Anteil an Erkrankungen durch multiresistente Bakterienstämme (MDR-TB) lag im Jahr 2020 bei 2,7% (79 Fälle).
RKI 2021, Bericht zur Epidemiologie der Tuberkulose in Deutschland für 2020 (PDF, 106 Seiten)
2. September 2022
Eravacyclin (XERAVA) in Deutschland im Handel
Am 1. August 2022 startete die Vermarktung von Eravacyclin (XERAVA) für die Behandlung komplizierter intraabdomineller Infektionen in Deutschland, wie das Pharmaunternehmen Paion AG, Aachen, mitteilte. Das Tetrazyklinderivat wurde von der EMA bereits vor vier Jahren europaweit zugelassen, es kann jetzt erstmals in Deutschland im Direktvertrieb bestellt werden. Das Arzneimittel wird als „Reserveantibiotikum“ eingestuft. Weitere Informationen zu dem Antibiotikum finden Sie in unserer Zusammenfassung der Produkteigenschaften, die im Heft 4, 2019 der Zeitschrift erschien.
August 2022
24. August 2022
Rationale Therapieoption bei Hepatitis D
Bulevirtid (HEPCLUDEX) ist ein lineares Peptid, das aus 47 L-Aminosäuren besteht. Das Molekül bindet an den Gallensäuretransporter NTCP (sodium taurocholate co-transporting polypeptide) und blockiert dadurch den Eintritt der Hepatitis B- und Hepatitis D-Viren in die Hepatozyten. Da bisher keine Phase-3-Studie vorlag hat die europäische Arzneimittelbehörde EMA im Juli 2020 nur eine bedingte Zulassung für Bulevirtid erteilt. Zwei Jahre später wurden Ergebnisse einer Phase-3-Studie vorgestellt. Die noch nicht abgeschlossene Studie MYR301 prüft eine Bulevirtid-Monotherapie bei 150 Patienten mit täglich 2 mg oder 10 mg vs. keine Therapie. Der Endpunkt war eine Kombination aus nicht mehr detektierbarer HDV RNA (oder ein Absinken von ≥ 2 log10IU/mL ab Baseline) und eine Normalisierung der Alanintransferase (ALT). Dies wurde in beiden Therapiearmen nach 48 Wochen signifikant häufiger erreicht als im Arm ohne Therapie.
22. August 2022
Prospektive Studie widerlegt mangelhafte Therapie-ansätze bei COVID-19
Zahlreiche Arzneistoffe zeigen in vitro antivirale und antiinflammatorische Eigenschaften. Was liegt näher, als diese Substanzen bei Virusinfektionen anzuwenden, wenn keine wirksame Therapie bekannt ist? Solche Überlegungen führten zur Anwendung von Dutzenden Wirkstoffen bei COVID-19 ohne eindeutigen Nachweis der Wirksamkeit. In manchen Fällen kamen Erfolgsmeldungen aus Fallberichten oder retrospektiven Studien hinzu. Prospektive, kontrollierte klinische Studien zeigten dann jedoch, dass ein eindeutiger Nutzen durch solche Therapeutika („repurposed drugs“) nicht nachweisbar war. Ein erstes und bekanntes Beispiel für solch eine Karriere ist Hydroxychloroquin, über drei weitere Substanzen wird aktuell im New England Journal of Medicine berichtet.
Das Antidiabetikum Metformin, das Anthelminthikum Ivermectin und Fluvoxamin, das bei Depressionen angewandt wird, wurden in den USA unter Verwendung einer Placebokontrolle prospektiv bei COVID-19-Patienten untersucht. Die Studienteilnehmer litten seit drei bis sieben Tagen unter den Symptomen einer COVID-19-Erkrankung, sie waren zwischen 30 und 85 Jahre alt, etwa die Hälfte war weiblich, alle waren übergewichtig mit einem BMI von 30 im Median. Keines der drei geprüften Arzneimittel führte zu einer Besserung der Symptomatik, einem Rückgang der stationären Behandlungen, keines verhinderte die Entstehung einer Hypoxämie oder einen tödlichen Verlauf der Erkrankung.
Fazit: Die Pandemie hat die Notwendigkeit prospektiver Studien nochmals so deutlich gemacht, wie kaum ein anderes Ereignis zuvor. Retrospektive Studien, insbesondere wenn sie nur eine geringe Zahl von Patienten erfassen, können zu falschen Therapieentscheidungen führen. Bei fehlender Wirksamkeit bekommen potenzielle Neben-wirkungen der Therapie jedoch eine besondere Bedeutung. Keine Therapie ist dann besser als eine ohne Nutzen.
16. August 2022
Aktuelle Ausgabe (Heft 4, 2022) Übersicht:
„Perioperative Antibiotikaprophylaxe - Update 2022“
Postoperative Wundinfektionen zählen zu den häufigsten nosokomialen Infektionen in Deutschland und weltweit, in der EU sind es etwa 800.000 pro Jahr. Es wird geschätzt, dass bis zu 50% der Infektionen vermeidbar sind. Strategien zur Verhinderung einer Wundinfektion sind komplex und umfassen präoperative, intraoperative und postoperative Maßnahmen. Die perioperative Antibiotikaprophylaxe ist eine bei vielen Eingriffen sehr wirksame Maßnahme zur Reduktion postoperativer Wundinfektionen. Die meisten Patienten können dabei Basissubstanzen, wie Cefazolin oder Amoxicillin / Clavulansäure, erhalten. Spezielle Kollektive (hochkomplexe Eingriffe mit sehr hohen Infektionsraten und / oder Kolonisation durch resistente Erreger) profitieren von einer Anpassung der Prophylaxe an das präoperativ nachgewiesene Erregerspektrum. Die Individualisierung der Prophylaxe wird zukünftig weiter an Bedeutung zunehmen. Sie erfordert eine enge Kooperation zwischen chirurgischen, anästhesiologischen und infektionsmedizinischen Teams im Sinne eines Antimicrobial Stewardship. Dies gilt ebenfalls für die korrekte Durchführung der perioperativen Antibiotika-prophylaxe, insbesondere die Vermeidung postoperativer Antibiotikagaben.
Den Übersichtsartikel von Herrn Professor Christian Eckmann zu diesem Thema lesen Sie in der aktuellen Ausgabe der Zeitschrift für Infektionstherapie (Heft 4, 2022). Die in dem Beitrag zitierte Literatur finden Sie hier.
Heft 4.2022 jetzt im Onlineshop bestellen
Heft 4.2022
und weitere Ausgaben kostenlos für Mitglieder der
Paul-Ehrlich-Gesellschaft für Infektionstherapie e.V.
Mitglieder der Paul-Ehrlich-Gesellschaft erhalten die Zeitschrift kostenlos (gedruckt oder als E-Paper), wenn sie der Geschäftsstelle der PEG ihre Anschrift auf dem Formblatt mitteilen.
8. August 2022
Affenpocken – weltweit rascher Anstieg der Fallzahlen
In Ländern außerhalb Afrikas wurden bis zum April 2022 Fälle von Affenpocken beim Menschen nur selten registriert. Heute treten sie weltweit auf und die Zahl der Meldungen steigt rasch. Seit dem 23. Juli gilt laut WHO der Affenpocken-Ausbruch als eine „gesundheitliche Notlage von internationaler Tragweite“. Aktuelle Fallzahlen werden von der WHO sowohl für verschiedene Regionen und detailliert für einzelne Länder bereit gestellt („Dashboard“ der WHO). Insgesamt werden demnach aktuell fast 30.000 Fälle registriert, davon mehr als 17.000 in Europa. Deutschland zählt mit knapp 3.000 Fällen zu den am stärksten betroffenen Ländern.
Impfung wird empfohlen, Impfstoff ist aber knapp
Die Ständige Impfkommission (STIKO) empfiehlt hierzulande den Impfstoff Imvanex (Handelsname in den USA: Jynneos) zur Postexpositionsprophylaxe nach Affenpocken-Exposition sowie zur Indikationsimpfung für Personen mit einem erhöhten Expositions- und/oder Infektionsrisiko. Um die aktuelle Infektionswelle abzuschwächen, die Ausbreitung der Affenpocken zu verlangsamen und schließlich den Ausbruch zu beenden, ist eine hohe Impfquote bei den Indikationsgruppen erforderlich. Zur Grundimmunisierung sind zwei Impfdosen mit einem Mindestabstand von vier Wochen vorgesehen. Die STIKO empfiehlt, angesichts der Knappheit des Impfstoffs, diesen zunächst nur für Erstimpfungen einzusetzen und Zweitimpfungen zu einem späteren Zeitpunkt vorzunehmen. Bereits die erste Impfdosis vermittelt einen Basisschutz, die zweite Dosis verlängert nach bisherigen Kenntnissen vor allem die Dauer des Schutzes.
Tecovirimat – ein wirksames Arzneimittel ist zugelassen aber schwer verfügbar
Mit Tecovirimat (Tecovirimat SIGA® 200 mg) wurde ein spezifisch antiviral wirksamer Arzneistoff für die Behandlung der Pocken oder Affenpocken zugelassen. Die klinischen Erfahrungen sind allerdings sehr limitiert, ebenso unklar sind mögliche Risiken der Resistenzentwicklung bei breiter Anwendung. Auch dieses Arzneimittel ist ähnlich wie der Impfstoff in Deutschland nur sehr eingeschränkt verfügbar. Sollte es aktuell zu einer Affenpocken-Erkrankung kommen und eine hohe Wahrscheinlichkeit für einen schweren Krankheitsverlauf bestehen, wird dringend geraten, mit dem regional zuständigen STAKOB-Behandlungszentrum (www.rki.de/stakob) Kontakt zur therapeutischen Beratung aufzunehmen.
Aktuelle Serie von mehr als 500 Fällen im New England Journal of Medicine
Ein internationales Team von Autoren berichtet im New England Journal of Medicine über insgesamt 528 Patienten aus 16 Ländern, die an Affenpocken erkrankt waren. Mit 98% waren es überwiegend Männer mit sexuellem Kontakt zu anderen Männern, bei fast jedem zweiten lag eine HIV-Infektion vor. Hautläsionen waren die häufigste Veränderung, es handelte sich meist um weniger als zehn vesikulo-pustuläre Veränderungen, die Art und Häufigkeit der Läsionen war jedoch sehr variabel. Als häufigste systemische Symptome werden Fieber (62%), Lethargie (41%), Myalgien (31%) und Kopfschmerzen (27%) genannt. Bei mehr als der Hälfte der Fälle bestand eine Lymphadenopathie. Eine stationäre Behandlung war in 13% der Fälle notwendig, eine spezifische Behandlung mit antiviralen Arzneimitteln erfolgte nur selten: acht Patienten erhielten Tecovirimat, zwölf wurden mit Cidofovir behandelt. Todesfälle wurden nicht berichtet.
Juli 2022
19. Juli 2022
Die SUPPORT-Studie aus Jena:
infektiologische Beratung bei bakteriämischen Staphylokokken-Infektionen
Der Nachweis von Staphylococcus aureus als Erreger einer Infektion erfordert eine Reihe von Maßnahmen. Antibiotika mit schmalem Spektrum kommen gezielt zum Einsatz. Bei Methicillin-empfindlichen Stämmen kann zum Beispiel Cefazolin oder Flucloxacillin verwendet werden, bei Methicillinresistenz (MRSA) Daptomycin oder Vancomycin. Bei Abszessen oder Fremdkörperbeteiligung ist die zusätzliche Gabe von Fosfomycin oder ggf. Rifampicin zu erwägen. Je nach dem ob es sich um eine komplizierte oder unkomplizierte Infektion handelt wird die Dauer der Antibiotikatherapie zwei Wochen oder länger betragen. Zwei oder drei Tage nach Therapiebeginn sollten erneut Blutkulturen zur mikrobiologischen Kontrolle angelegt werden.
Da weitere spezielle Aspekte bei diesen oft lebensbedrohlichen Infektionen beachtet werden müssen, wurde in Thüringen der Einfluss einer gezielten Beratung durch Infektiologen auf das Therapieergebnis untersucht. An der Studie nahmen 21 Krankenhäuser teil, die nicht zu den Universitätskliniken gehörten. Initial wurden die mehr als 1.000 Patienten mit Nachweis von S. aureus in der Blutkultur erfasst, 386 Patienten konnten in diese cluster-randomisierte Studie eingeschlossen werden. Ohne weitere Aufforderung erfolgte in den Kliniken eine telefonische Beratung der behandelnden Ärztinnen und Ärzte (Interventionsphase), wenn durch ein automatisiertes Berichtssystem eine Blutkultur mit S. aureus-Nachweis an das Universitäts-klinikum Jena gemeldet wurde. Nach Abschluss der Interventionsphase wurde in diesen Einrichtungen keine Beratung mehr durchgeführt (Kontrollphase). Der Wechsel von einer Phase zur anderen erfolgte in der Regel nach 15 Patienten. Der Inhalt der Beratung wurde zusätzlich per Fax zur Verfügung gestellt. Innerhalb von 30 Tagen nach dem ersten Nachweis von S. aureus in einer Blutkultur, verstarben 4% (7/177) der Patienten in der Beratungsgruppe und 4,8% (10/209) in der Kontrollgruppe. Der Unterschied war statistisch nicht signifikant. Das gilt auch für den Unterschied in der Sterblichkeit nach 90 Tagen (10,2% vs. 12,0%). In dieser als SUPPORT-Studie bekannten Untersuchung lag die Letalität niedriger als erwartet, obwohl vorab definierte Qualitätsparameter (z.B. Folgeblutkulturen, Focussanierung, korrekte Antibiotikagabe) durch die Beratung signifikant häufiger erfüllt wurden. Jedoch war die Zahl der Patienten zu niedrig, um einen signifikanten Letalitätsunterschied durch die Beratung nachzuweisen. Darüber hinaus zeigte sich im Laufe der Studie, dass die Beratung meist zu spät erfolgte. Im Median vergingen fünf Tage zwischen der Blutabnahme für die mikrobiologische Diagnostik und der infektiologischen Beratung, 9% der als Studienteilnehmer in Frage kommenden Patienten waren vor der Randomisierung bereits verstorben.
Das Fazit dieser Studie lautet, dass die telefonische Intervention offenbar nicht geeignet ist, die Behandlung von Patienten mit bakteriämischen S. aureus-Infektionen zu optimieren. Eine direkte und frühzeitige infektiologische Beratung am Krankenbett bleibt daher bei dieser lebensbedrohlichen Erkrankung das geeignetere Vorgehen.
Juni 2022
23. Juni 2022
Isavuconazol:
ist ein therapeutisches Drug Monitoring sinnvoll?
Ein therapeutisches Drug Monitoring wird zur Optimierung einer Therapie mit einigen Azol-Antimykotika wie z. B. Voriconazol oder Posaconazol empfohlen. Ob eine Bestimmung der Plasmaspiegel auch bei Isavuconazol sinnvoll ist, wird kontrovers diskutiert. Ein Team von Wissenschaftlern aus Nürnberg wertete die Daten von 41 Patienten aus, die auf einer Intensivstation mit Isavuconazol intravenös in üblicher Dosierung behandelt wurden. Mehr als 200 Blutproben wurden auf ihren Gehalt an Isavuconazol untersucht. Die Mittelwerte der Spitzen- und Talspiegel lagen bei 2,43 und 1,77 mg/l. Ein Blick auf den Konzentrationsbereich zeigt die hohe Variabilität: die Spitzenspiegel schwankten zwischen 0,41 und 7,79 mg/l, die Talspiegel zwischen 0,24 und 4,96 mg/l. Bei jedem dritten Patienten wurden Konzentrationen von weniger als 1 mg/l gemessen - dieser Spiegel gilt als Grenzwert bei der Behandlung einer Infektion mit Aspergillus fumigatus. Therapeutisch relevant ist auch die Beobachtung, dass die Konzentrationen des Antimykotikums bei Patienten mit einem BMI von 25 oder mehr signifikant niedriger waren als bei Kranken mit einem geringeren BMI. Ein höherer SOFA-Score korrelierte ebenfalls signifikant mit niedrigeren Spiegeln des Arzneimittels. Weitere Studien sind erforderlich, um die klinische Bedeutung der Resultate zu klären.
15.Juni 2022
Aktuelle Ausgabe Heft 3, 2022
Übersicht: „Ein Unglück kommt selten allein - Management von opportunistischen Infektionen mit seltenen Pilzen“
Seltene Erreger invasiver Pilzinfektionen werden uns zunehmend beschäftigen. Das Wissen über die Diagnostik und Therapie seltener Pilzerkrankungen ist ein entscheidender Faktor, um den Krankheitsverlauf und die Überlebenswahrscheinlichkeit zu beeinflussen. Eine schnelle Aufarbeitung führt zu einem besseren Behandlungsergebnis, weshalb Hilfsmittel wie die EQUAL Score Cards einen schnellen Überblick verschaffen und hilfreich für das klinische Management sein können. Zur weiteren Erforschung dieser seltenen Infektionen sind Fallregisterstudien eine zweckmäßige Methode. Im Jahr 2003 wurde in Köln das weltweite Register „Fungiscope“ für seltene, invasive Pilzinfektionen etabliert, um ein evidenzbasiertes Management bei neuen Mykosen zu fördern.
Den Übersichtsartikel der Autoren Rosanne Sprute und Oliver A. Cornely, Uniklinik Köln, zu diesem Thema lesen Sie in der aktuellen Ausgabe der Zeitschrift für Infektionstherapie (Heft 3, 2022). Die in dem Beitrag zitierte Literatur finden Sie hier.
Heft 3.2022 jetzt im Onlineshop bestellen
9. Juni 2022
Therapeutisches Drug Monitoring bei Behandlung mit Piperacillin / Tazobactam
Plasmakonzentrationen von ß-Laktamantibiotika unterliegen bei kritisch kranken Patienten einer hohen, nicht exakt vorhersehbaren Variabilität. Zunehmend häufig wird daher die Bestimmung der Konzentrationen empfohlen, um optimale Bedingungen sicherzustellen. Verbessert solch ein therapeutisches Drug Monitoring (TDM) die Einhaltung der pharmakologischen Zielgröße (fT>MHK), also der Zeitdauer, während der die freie Konzentration oberhalb der MHK liegt, und vor allem auch das Therapieresultat? Um diese Fragen zu beantworten wurden insgesamt 249 Patienten mit Sepsis in eine randomisierte, kontrollierte Studie aufgenommen, die in Jena und zwölf anderen Städten in Deutschland in den Jahren 2017 bis 2019 durchgeführt wurde. Beide Gruppen erhielten Piperacillin / Tazobactam als kontinuierliche Dauerinfusion wobei in der TDM-Gruppe die Dosierung täglich nach Höhe der Plasmakonzentration angepasst wurde. Sie sollte viermal höher sein als die minimale Hemmkonzentration (MHK) des Erregers, bei empirischer Therapie wurde dafür eine Konzentration von 16 mg/l angenommen. Dieses Ziel wurde durch das TDM bei 37,3% der Patienten erreicht, ohne die Spiegelbestimmung jedoch nur bei 14,6% (p<0,001). Der Anteil von Patienten mit einer Heilung nach klinischen oder mikrobiologischen Kriterien war ebenfalls höher: innerhalb von 28 Tagen verstarben weniger Patienten in der TDM-Gruppe (21,6% vs. 25,8%). Ein geringer Unterschied bestand beim mittleren SOFA-Score (7,9 vs. 8,2 Punkte), dem primären Endpunkt der Studie. Alle Unterschiede waren nach üblichen Maßstäben allerdings nicht statistisch signifikant.
03. Juni 2022
Ceftriaxon-Dosierung bei kritisch kranken Patienten
Bei kritisch kranken Patienten beeinflussen infektionsbedingte physiologische Veränderungen die Pharmakokinetik von Antibiotika wie zum Beispiel Ceftriaxon. Insbesondere verhindern eine Hypalbuminämie und eine erhöhte renale Clearance ausreichend hohe Konzentrationen des Cephalosporins bei üblicher Dosierung von zweimal 1,0 g täglich. Eine aktuelle Studie aus Australien zeigt, dass bei normaler Kreatinin-Clearance die zweimal tägliche Infusion von jeweils 1,0 g Ceftriaxon wahrscheinlich ausreichend ist, wenn der verursachende Erreger durch Konzentrationen von ≤ 0,25 mg/l gehemmt wird. Beim Vorliegen einer Hypalbuminämie und / oder einer erhöhten Kreatinin-Clearance sind allerdings höhere Dosierungen von Ceftriaxon erforderlich, die als kontinuierliche Infusion oder in mehreren Einzeldosen verabreicht werden können. Bei Patienten mit erhöhter renaler Clearance sind eine frühzeitige Entscheidung für relativ hohe Dosierungen und auch eine Bestimmung der Blutspiegel sinnvoll.
Mai 2022
22. Mai 2022
Tecovirimat – Zulassung in der EU unter außergewöhnlichen Umständen
Im Januar 2022 wurde das antiviral wirksame Tecovirimat (ST-246) in der Europäischen Union unter „außergewöhnlichen Umständen“ zur Behandlung der Pocken, Kuhpocken und Affenpocken zugelassen.1 Aus ethischen Gründen war es laut EMA nicht möglich, vollständige Informationen zu diesem Arzneimittel zu erhalten. Klinische Studien konnten nicht durchgeführt werden, da die Erkrankungen nicht vorkommen oder auf Einzelfälle beschränkt sind. Verfügbar sind jedoch Ergebnisse von In-vitro-Untersuchungen zur antiviralen Aktivität, zur Pharmakokinetik bei Probanden sowie Wirksamkeitsstudien bei Kaninchen und Affen. Eine 14-tägige Behandlung mit Tecovirimat führte zu einer deutlichen Verbesserung des Überlebens im Vergleich zu Placebo, wenn die Behandlung innerhalb von vier bis sechs Tagen nach der Exposition begonnen wurde.2 Die empfohlene Dosierung von Tecovirimat für Erwachsene mit einem Körpergewicht von mehr als 40 kg beträgt alle 12 Stunden 600 mg (drei Kapseln mit 200 mg) oral. Die EMA wird alle neuen Informationen, die verfügbar werden, jährlich bewerten und die Informationen zu diesem Arzneimittel aktualisieren.
1. EMA, 2022, Zusammenfassung der Merkmale des Arzneimittels Tecovirimat SIGA 200 mg Hartkapseln.
22. Mai 2022
Pharmakologisches Profil von Tecovirimat
Über die antiviralen Wirkungen des Tecovirimat wurde bereits 2005 berichtet. Der Wirkstoff hemmt die Aktivität des Proteins VP37, das für die Replikation des Pockenvirus, Affenpockenvirus und anderer Orthopoxviren essentiell ist. Während der intrazellulären Reifung spielt dieses Protein bei den letzten Schritten der Umhüllung der Virionen und der Freisetzung aus der Zelle eine essenzielle Rolle. Durch die Inhibition wird die Verbreitung der Viren im Wirtsorganismus unterbunden. Untersuchungen in Zellkulturen zeigten wirksame Konzentrationen von Tecovirimat im Bereich von 0,014-0,067 μM für Pocken- und Affenpockenviren. Der Wirkstoff hat eine relativ niedrige Resistenzbarriere, und bestimmte Aminosäuresubstitutionen im Zielprotein VP37 können die antivirale Aktivität von Tecovirimat stark verringern. Etwa vier bis sechs Stunden nach der Einnahme mit Nahrung werden maximale Plasmakonzentrationen von ca. 2,2 mg/l bzw. 5,8 µmol erreicht, das Verteilungsvolumen ist groß (ca.1300 l). Mehrere Metaboliten wurden nachgewiesen. Tecovirimat ist ein Substrat, Inhibitor und Induktor von Cytochrom-P450-Enzymen, Interaktionen mit anderen Arzneistoffen können resultieren. Es wird als Glukuronid renal eliminiert, mit den Fäzes wird es unverändert ausgeschieden. Die Eliminationshalbwertzeit liegt bei 19 Stunden. Klinische Studien zur Wirksamkeit bei den zugelassenen Indikationen liegen nicht vor. Kopfschmerzen, Schwindel und gastrointestinale Beschwerden wurden als häufigste unerwünschte Wirkungen in den Probandenstudien beobachtet.
17. Mai 2022
Lenacapavir –
ein Kapsid-Inhibitor zur Behandlung der HIV-Infektion
Für die Therapie einer HIV-Infektion stehen heute zahlreiche Arzneimittel aus mehreren Klassen zur Verfügung. Zur primären Behandlung werden häufig Kombinationen aus Hemmstoffen der reversen Transkriptase und der Integrase eingesetzt, alternativ stehen Virustatika mit anderen Angriffspunkten zur Verfügung. Trotzdem gibt es therapeutisch schwierige Situationen, wenn bei einem Patienten Mehrklassenresistenz festgestellt wird. Vor diesem Hintergrund ist die Entwicklung einer neuen Substanz mit innovativem Wirkmechanismus von hohem Interesse. Lenacapavir ist ein Kapsid-Inhibitor.1 Zwei Stränge der RNA und die Enzyme des HI-Virus werden von dem Kapsid umschlossen - einer Hülle, die aus dem Protein p24 besteht. Aus p24 werden zunächst 12 Pentamere und 250 Hexamere gebildet, die sich dann zu einem reifen Kapsid zusammenlagern. Die intakte Struktur des Kapsids ist essentiell für die Virusreplikation. Interessanterweise spielt es sowohl während der frühen als auch der späten Phase der Replikation eine entscheidende Rolle. Neben der hohen antiviralen Aktivität bereits im pikomolaren Konzentrations-bereich ist auch die sehr langsame Elimination von Lenacapavir bemerkenswert: nach einer subkutanen Injektion werden für sechs Monate ausreichende Wirkspiegel erreicht.1 Während zahlreiche andere Virustatika aus dieser Klasse wegen verschiedener Nachteile nicht weiterentwickelt wurden, liegen mit Lenacapavir inzwischen Ergebnisse aus klinischen Studien vor.2
17. Mai 2022
Lenacapavir –
erste klinische Daten zeigen hohe Wirksamkeit
Daten der CAPELLA-Studie mit Lenacapavir wurden vor einigen Tagen im New England Journal of Medicine veröffentlicht. An dieser Phase 3-Studie nahmen 36 Patienten mit einer multiresistenten HIV-Infektion teil, bei denen eine virale RNA-Konzentration von 400 Kopien pro Milliliter oder mehr gemessen wurde. Zu Beginn der Behandlung erhielten die Teilnehmer den Wirkstoff oder ein Placebo bis zum Tag 14 oral, die Placebogruppe erhielt den Wirkstoff ab Tag 15. Die Dosierung von Lenacapavir betrug initial 600 mg (Tag 1 und 2), danach 300 mg (Tag 8). Anschließend wurde eine Dosis von 927 mg subkutan unter die abdominelle Haut gespritzt. Alle erhielten zusätzlich die bisherige unzureichende Therapie („optimized background therapy“). In der Lenacapavirgruppe wurde eine Reduktion der Viruskonzentration um mindestens 0,5 log10 Kopien pro Milliliter bei 21 von 24 Teilnehmern ermittelt, in der Placebogruppe war dies bei 2 von 12 Patienten der Fall. Damit konnte in dieser Studie nachgewiesen werden, dass sich mit Lenacapavir bei Patienten mit einer unzureichend wirksamen antiretroviralen Therapie eine hohe Rate an virologischer Suppression und klinisch bedeutsame Erhöhungen der CD4-Zellzahlen erzielen lassen.
Wann ist mit einer Zulassung des Arzneimittels zu rechnen? Der Hersteller Gilead teilte vor einigen Monaten mit, dass der Zulassungsantrag für Lenacapavir von der Europäischen Arzneimittelagentur (EMA) geprüft wird. Die vorgeschlagene Indikation ist die „Behandlung von HIV-1-Infektionen in Kombination mit anderen antiretroviralen Medikamenten bei Erwachsenen mit multiresistenten HIV-1-Infektionen, bei denen eine antiretrovirale Behandlung aufgrund von Resistenz, Unverträglichkeit oder Sicherheitsbedenken derzeit versagt.“
2. Mai 2022
Neue Omikron-Varianten BA.4 und BA.5
Die SARS-CoV-2 Omikron Variante (B.1.1.529) wird trotz Impfung oder vorheriger Infektion mit anderen Varianten immunologisch unzureichend neutralisiert („immune escape“), erneute Infektionen mit diesem Virustyp auch bei Geimpften und Genesenen sind die Folge. Die zunächst isolierte Omikron-Variante wurde als BA.1 bezeichnet, nun wird aus Südafrika über die neuen Varianten BA.4 und BA.5 berichtet. Zu ihren charakteristischen Merkmalen im Vergleich zu BA.1 gehören die Veränderungen L452R and F486V im Spikeprotein, also der Ersatz der Aminosäuren Leucin durch Arginin und Phenylalanin durch Valin. Die WHO stufte bereits auch diese Varianten als „besorgniserregend“ ein. Patienten, die zuvor mit BA.1 infiziert waren, zeigten eine reduzierte neutralisierende Immununität gegenüber den neuen Varianten. Bei Personen, die mit den Vakzinen von Biontech/Pfizer oder Johnson & Johnson geimpft worden waren, zeigte sich ebenfalls eine reduzierte neutralisierende Wirkung, der Effekt war aber im Vergleich zur Infektion geringer ausgeprägt. Weil keine effektive neutralisierende Abwehr durch eine BA.1-Infektion erworben wird, erscheint eine weitere Welle an Infektionen mit den neuen Varianten wahrscheinlich. Da Impfstoffe einen gewissen Schutz induzieren, könnten durch die Impfung schwere Verläufe der Infektion verhindert werden.
April 2022
20. April 2022
Antibiotika mit schmalem Spektrum zur Behandlung der ambulant erworbenen Pneumonie
Erwachsene, die mit einer mittelschweren, ambulant erworbenen Lungenentzündung stationär aufgenommen werden, erhalten häufig Antibiotika mit breitem antibakteriellen Spektrum, obwohl in den niederländischen Leitlinien Antibiotika mit schmalem Spektrum empfohlen werden. Daher haben niederländische Wissenschaftler untersucht, ob eine Antibiotika-Stewardship-Intervention den Einsatz von Breitspektrum-Antibiotika verringern würde, ohne das Therapieergebnis zu beeinträchtigen. An der Studie, die in 12 Krankenhäusern durchgeführt wurde, nahmen mehr als 5.000 Pneumonie-Patienten ohne Immunsuppression teil. Die antimikrobielle Stewardship-Intervention war eine Bündelstrategie bestehend aus Aufklärung, Einbindung von Meinungsführern sowie Prüfungen und Rückmeldungen zum Antibiotikaeinsatz. Die mittlere Anzahl der Therapietage mit Breitspektrumantibiotika pro Patient wurde von 6,5 Tagen im Kontrollzeitraum auf 4,8 Tage im Interventionszeitraum reduziert, was einer relativen Reduktion von 27% entsprach. Die 90-Tage-Mortalität lag im Kontrollzeitraum bei 10,9 % und im Interventionszeitraum bei 10,8 %. Bei dieser Patientengruppe könnte damit eine vielseitige Antibiotika-Stewardship-Intervention den Einsatz von Antibiotika mit breitem antibakteriellen Spektrum signifikant reduzieren, ohne die Sterblichkeit zu erhöhen.
19. April 2022
Aktuelle Ausgabe Heft 2, 2022
Übersicht:
„Medikamentöse Therapie bei COVID-19: was ist neu?“
Bei der antiviralen Therapie einer Infektion mit SARS-CoV-2 spielt der Zeitpunkt des Therapiebeginns eine entscheidende Rolle. Neutralisierende monoklonale Antikörper, die den Viruseintritt in die Zelle verhindern sowie Virostatika, die direkt auf die Unterbrechung der viralen Replikation und Proteinsynthese abzielen, sind in der frühen replikativen Phase der SARS-CoV-2-Infektion sinnvoll, bevor (hyper-) inflammatorische Prozesse über den weiteren Verlauf der Erkrankung entscheiden.
Unter den verfügbaren Antikörpern ist nur Sotrovimab gegen die aktuell vorherrschende Omikron-Variante (Subtyp BA.1 und BA.1.1) wirksam. Zur in vitro Wirksamkeit gegen den Subytp BA.2 fehlen noch die abschließenden Bewertungen. Auch für die Virostatika Nirmatrelvir/Ritonavir, Molnupiravir und Remdesivir konnte ein verringertes Risiko für einen schweren Verlauf nachgewiesen werden, wenn die Therapie innerhalb von fünf bis sieben Tagen nach Symptombeginn beginnt. Jeder Wirkstoff hat spezielle unerwünschte Wirkungen, Interaktionsrisiken oder Kontraindikationen.
Der differenzierte Einsatz von antiinflammatorischen Substanzen nach Ablauf der initialen Krankheitsphase wird in der aktuellen Version der S3-Leitlinie beschrieben. Dabei geht es neben den Kortikosteroiden, die einen unbestrittenen Stellenwert in der Behandlung von sauerstoffpflichtigen und/oder mechanisch beatmeten COVID-19-Patienten haben, um die Wirkstoffe Tocilizumab, Baricitinib und Anakinra.
Eine Thromboembolie-Prophylaxe ist sowohl im stationären Sektor als auch bei ambulanten Hochrisikopatienten ein wichtiger Therapiebaustein.
Den Übersichtsartikel der Autoren Agata Mikolajewska und Christian Karagiannidis zu diesem Thema lesen Sie in der aktuellen Ausgabe der Zeitschrift für Infektionstherapie (Heft 2, 2022). Die in dem Beitrag zitierte Literatur finden Sie hier.
Heft 2.2022 jetzt im Onlineshop bestellen
9. April 2022
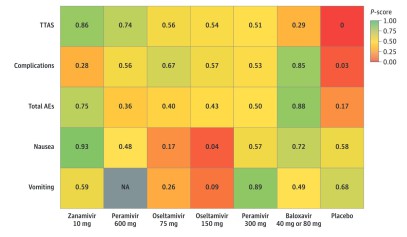
Metaanalyse randomisierter Studien zu Influenza-Virustatika
Zur antiviralen Therapie der Influenza stehen verschiedene Substanzen zur Verfügung: Die Neuraminidase-Inhibitoren Oseltamivir (p.o.), Peramivir (i.v., in Deutschland über Import erhältlich), Zanamivir (p.i.) und der Endonuklease-Inhibitor Baloxavir (p.o.).
In dieser Metaanalyse wurden alle randomisiert kontrollierten Studien ausgewertet, die diese vier Virustatika gegeneinander oder gegen Placebo verglichen haben. Die Autoren konnten 26 Studien mit insgesamt ca. 12.000 Patienten identifizieren.1 Dabei zeigte das inhalative Zanamivir gegenüber Placebo die stärkste Verkürzung der Zeit bis zur Symptombesserung (time to alleviation of symptoms, TTAS) (Hazard Ratio, 0,67; 95% CI, 0,58-0,77). Baloxavir zeigte gegenüber Placebo die stärkste Reduktion von Komplikationen der Influenza-Infektion (z.B. Pneumonie, Hospitalisierung, Risk ratio 0,51; 95% CI, 0,32-0,80). Übelkeit als typische Nebenwirkung zeigte sich signifikant häufiger unter Oseltamivir und vergleichsweise selten unter Baloxavir.
Abb. 1: Heat Map von Effekten und Verträglichkeit der verschiedenen Influenza-Virustatika. Ein hoher P-Wert ist günstig, ein niedriger ungünstig. NA: keine Daten, AE: Adverse Events, Nebenwirkungen, TTAS: time to alleviation of symptoms, Zeit bis zur Besserung der Symptome.
Fazit: Alle vier untersuchten Substanzen zeigten eine Wirksamkeit. In dieser Metaanalyse wurden allerdings nicht die während der jeweiligen Studie dominierenden Influenza-Stämme berücksichtigt. Klinische Studien haben belegt, dass Neuraminidase-Inhibitoren bei Influenza B deutlich abgeschwächt wirksam sind. Bei Baloxavir gab es keinen Unterschied zwischen Influenza A und B. Baloxavir wurde vom Hersteller allerdings vom deutschen Markt genommen, da der G-BA einen Zusatznutzen nur für die postexpositionelle Prophylaxe, nicht jedoch für die Therapie bescheinigte. Die S3-Leitlinie „Ambulant erworbene Pneumonie“ empfiehlt eine empirische antivirale Therapie für hospitalisationspflichtige Patienten mit Verdacht auf Influenza während der Saison.
9. April 2022
RSV-Prävention bei Säuglingen
Bei 5 % der gesunden Säuglinge tritt eine behandlungspflichtige RSV-Infektion in den ersten zwei Jahren auf. Das Respiratory Syncytial Virus (RSV) ist eine der Hauptursachen für Infektionen der unteren Atemwege und Krankenhausaufenthalte bei Säuglingen unter 2 Jahren.1 Bislang gibt es noch keine zugelassene aktive Impfung, aber die Option, Säuglinge mit einem hohen Risiko während der Saison durch eine passive Vakzinierung mit Palivizumab zu schützen.
Die erste Palivizumab-Gabe in Deutschland sollte dabei Anfang November eines jeden Jahres erfolgen. Die vier weiteren Dosen sollten in 4-wöchentlichen Abständen verabreicht werden, so dass die letzte (5.) Dosis zwischen Ende Februar und Anfang März verabreicht wird.
Nirsevimab ist ein monoklonaler Antikörper gegen das RSV-Fusionsprotein, der gegenüber Palivizumab eine verlängerte Halbwertszeit aufweist.2
In der Studie von Hammitt et al. wurden Säuglinge, die in einem Gestationsalter von mindestens 35 Wochen geboren wurden, im Verhältnis 2:1 nach dem Zufallsprinzip einer einmaligen intramuskulären Injektion von Nirsevimab oder Placebo vor Beginn einer RSV-Saison zugeteilt.3
Eine einmalige Injektion von Nirsevimab, die vor der RSV-Saison verabreicht wurde, schützte gesunde Spät- und Terminkinder vor einer medizinisch betreuten RSV-assoziierten Infektion der unteren Atemwege.3
Fazit: Die Zulassungsstudie zeigt, dass auch bei 5 % der gesunden Säuglinge eine behandlungspflichtige RSV-Infektion in den ersten zwei Jahren auftritt. Eine passive Impfung mit Palivizumab (5 i.m. Gaben alle 4 Wochen ab November) wird derzeit allerdings nur bei zusätzlichen Risikofaktoren empfohlen. Nirsevimab ist ein monoklonaler Anti-RSV-Antikörper mit einer längeren Halbwertzeit als Palivizumab. In dieser Studie reichte eine einmalige Injektion, um einen Großteil der schweren RSV-Infektionen während der gesamten Saison zu verhindern.
Der Hersteller hat im Februar 2022 bei der European Medical Agency die Zulassung für die Prävention von RSV-Infektionen für alle Säuglinge – unabhängig von einer Risikokonstellation– beantragt. Im Falle einer positiven Entscheidung der EMA bleibt abzuwarten, ob die Fachgesellschaft (DGPI) und die STIKO den Einsatz auch für gesunde Säuglinge empfehlen.
März 2022
9. März
Verschreibung und Abgabe der oral wirksamen COVID-19-Medikamente
Das Bundesinstitut für Arzneimiittel und Medizinprodukte (BfArM) hat Informationen zu den Arzneimitteln Paxlovid® (Nirmatrelvir/r) und Lagevrio® (Molnupiravir) zusammen-gestellt. Die Arzneimittel werden übergangsweise ohne bzw. mit englischsprachiger Gebrauchsinformation in Verkehr gebracht. Die Apotheken dürfen die Arzneimittel nur bei Vorliegen einer ärztlichen Verschreibung beim Großhandel bestellen und an Patienten abgeben. Eine Bestellung auf Vorrat ist weder für Apotheken noch für Ärzte zulässig. Dies gilt auch für Krankenhausapotheken.
Geht beim Großhandel die Bestellung einer Apotheke ein, hat der Großhandel das Arzneimittel unverzüglich an die Apotheke zu liefern. Die Apotheke hat das Arzneimittel per Botendienst an die Patienten abzugeben. Den Arzneimitteln müssen bei der Abgabe „Hinweise für den Anwendenden“ bzw. „Gebrauchsinformationen“ in Papierform beigelegt werden, die von der Apotheke ausgedruckt werden.
Weitere Details zum Umgang mit diesen Arzneimitteln finden Sie im BfArM-Newsletter März 2022
Februar 2022
24. Februar 2022
COVID-19-Impfung während der Schwangerschaft
Das Risiko für einen schweren Verlauf einer COVID-19-Erkrankung bei Schwangeren ist im Vergleich mit gleichalten, nicht-schwangeren Frauen deutlich erhöht. Trotzdem ist die Impfquote bei Schwangeren eher niedrig. Offensichtlich bestehen bei einem Teil der Frauen Sicherheitsbedenken. Die Datenbanken zur Sicherheit der COVID-19-Vakzinen in den USA liefern aktuell umfassende Informationen über mögliche Risiken.1 Von gut 46.000 Schwangeren erhielten 10.064 (21,8%) eine COVID-19-Impfung. Die Injektion erfolgte ganz überwiegend im 2. oder 3. Trimenon. Am häufigsten wurden COMIRNATY und SPIKEVAX verabreicht (zusammen >95%) und die Mehrheit der Frauen erhielt zwei Dosen während der Schwangerschaft (81,8%). Die Impfung führte weder zu einer erhöhten Rate an Frühgeburten (<37 Wochen) noch zu einem verringerten Geburtsgewicht der Kinder (SGA, small-for-gestational-age). Die positiven Erfahrungen mit COVID-19-Impfstoffen während der Schwangerschaft haben in vielen Ländern zu Impfempfehlungen der zuständigen Gremien geführt. In Deutschland spricht die STIKO eine Impfempfehlung für ungeimpfte Schwangere ab dem 2. Trimenon sowie für ungeimpfte Stillende aus.2 Empfohlen wird die Grundimmunisierung mit zwei Dosen des mRNA-Impfstoffs COMIRNATY. Wenn die Schwangerschaft nach bereits erfolgter Erstimpfung festgestellt wurde, sollte die Zweitimpfung erst ab dem 2. Trimenon durchgeführt werden. Eine akzidentelle COVID-19 Impfung im 1. Trimenon der Schwangerschaft ist keine Indikation für einen Schwangerschaftsabbruch.
2. STIKO-Empfehlung. Impfung bei Schwangeren, Stillenden und bei Kinderwunsch (Stand: 15.2.2022)
17. Februar 2022
Aktuelle Ausgabe Heft 1, 2022
Übersicht: „Next Generation Sequencing – eine zukunftsweisende Alternative in der mikrobiologischen Diagnostik“
Next Generation Sequencing (NGS) kann in Form von Metagenome Sequencing (mNGS) zur ungezielten Diagnostik von Infektionserregern eingesetzt werden. Es wird am ehesten in der Diagnostik akuter Infektionen Anwendung finden. NGS kann auch in der Form des so genannten Whole Genome Sequencing (WGS) wichtige Erkenntnisse für Mikrobiologen und Epidemiologen liefern. Für beide Verfahren sind jedoch nach wie vor die hohen Kosten ein entscheidender limitierender Faktor für ihren Einsatz im Routinelabor. Zudem stellt das Handling der bei NGS anfallenden enormen Datenmengen eine Herausforderung dar. Es bleibt daher abzuwarten, ob und wann diese neuen Technologien flächendeckend Einzug in mikrobiologische Laboratorien halten werden.
Den Übersichtsartikel zu diesem Thema lesen Sie in der aktuellen Ausgabe der Zeitschrift für Infektionstherapie (Heft 1, 2022). Die in dem Beitrag zitierte Literatur finden Sie hier.
Heft 1.2022 jetzt im Onlineshop bestellen
17. Februar 2022
Arzneimittelinteraktionen mit COVID-19-Therapeutika
Auf einer allgemein zugänglichen Internetseite informieren Pharmakologen der University of Liverpool bereits seit 1999 über mögliche Interaktionen zwischen HIV-wirksamen Arzneistoffen und anderen Medikamenten. In den folgenden Jahren dehnten sie ihre Aktivitäten auf Arzneimittel zur Behandlung der Hepatitis B oder C aus. Zu den neuesten Ergänzungen ihres Angebots gehören Informationen zu Arzneimitteln, die zur COVID-19-Therapie eingesetzt werden. Die möglichen Interaktionen mit anderen Wirkstoffen, sowie Dosierungshinweise bei Patienten mit eingeschränkter Nieren- und Leberfunktion stehen als PDF-Dateien zur Verfügung. Sie erleichtern so zum Beispiel die Therapie mit Nirmatrelvir/r (Paxlovid®), das stets hinsichtlich möglicher Interaktionen sorgfältig überprüft werden muss.
Website der Liverpool Drug Interaction Group,
Eine weitere Übersicht über mögliche Interaktionen zwischen Paxlovid® und anderen Arzneistoffen wurde von der Arbeitsgruppe COVRIIN veröffentlicht. (PDF-Datei, Stand: 10. Februar 2022)
Hinweise zu Arzneimittelwechselwirkungen von Paxlovid®
15. Februar 2022
Pharmakokinetik von Nirmatrelvir/r
Nirmatrelvir/r (Paxlovid®) ist für die Behandlung einer COVID-19-Erkrankung zugelassen. Die Dosierung beträgt zweimal täglich 300 mg Nirmatrelvir zusammen mit 100 mg Ritonavir. Die Daten einer umfangreichen Phase-1-Studie zur Pharmakokinetik des Virustatikums wurden jetzt veröffentlicht. Plasmakonzentrationen nach Dosen von 75 bis 750 mg, einzeln oder mehrfach verabreicht, geben Aufschluss über die Dosisabhängigkeit der Spiegel, über den Einfluss einer gleichzeitig verabreichten Mahlzeit und die Verträglichkeit supratherapeutischer Dosierungen. Die Bioverfügbarkeit war mit und ohne Nahrung sehr ähnlich. Die gleichzeitige Gabe des CYP3A4-Inhibitors und „Verstärkers“ Ritonavir erhöhte die Nirmatrelvirspiegel um etwa das Achtfache. Auch deutlich erhöhte Dosierungen (dreimal 750 mg plus Ritonavir innerhalb von vier Stunden) waren bei einer kleinen Gruppe von zehn Probanden gut verträglich, ein Unterschied zu Placebo war nicht zu erkennen. Die empfohlene Dosierung führt zu Konzentrationen, die kontinuierlich oberhalb der Konzentrationen liegen, die in vitro für eine 90-prozentige Hemmung der viralen Vermehrung notwendig sind.
2. Februar 2022
Aktivität von Ivermectin in SARS-CoV-2-infizierten Zellkulturen: auf den Zelltyp kommt es an!
Ivermectin wurde als Mittel zur Behandlung einer SARS-CoV-2-Infektion diskutiert. In vitro Daten und einige retrospektive Studien schienen eine therapeutische Verwendung zu unterstützen. Die Mehrheit der klinischen Studien konnte allerdings keinen Nutzen des Anthelminthikums belegen, es wird heute nicht zur Behandlung empfohlen. Eine aktuelle Studie zeigt nun, dass offenbar die in vitro Daten – die als Argument für eine Behandlung mit Ivermectin herangezogen wurden – nicht die Realität in einem lebenden Organismus abbildeten. Eine Gruppe von Wissenschaftlern in den Niederlanden verglich die Aktivität des Arzneistoffs in Vero E6-Zellen mit der Wirkung in Zellen aus den menschlichen Atemwegen. Sie fanden mit Vero E6-Zellen eine EC50 von etwa 2 µM, die EC90 lag bei 5,8 µM, was frühere Ergebnisse bestätigte. In einer Kultur von Zellen aus den menschlichen Atemwegen konnte jedoch kein antiviraler Effekt der Substanz bei einer höheren Konzentration von 10 µM festgestellt werden. Entsprechende Konzentrationen sind im menschlichen Organismus nicht erreichbar. Die Autoren warnen vor einer unkritischen Interpretation von antiviral wirksamen Arzneistoffkonzentrationen, die mit Hilfe von Vero-Zellen in vitro ermittelt wurden.
Januar 2022
27. Januar 2022
EMA empfiehlt Zulassung von Paxlovid
Die Kombination des Proteaseinhibitors Nirmatrelvir mit Ritonavir (PAXLOVID) wurde vom zuständigen Komitee CHMP der EMA für die Zulassung
empfohlen.1 Mit der Zustimmung der EU Kommission wird zeitnah gerechnet.* Da es sich um eine conditional marketing authorisation handelt, gilt sie zunächst nur für ein Jahr. Die
wichtigsten Fachinformationen über das Medikament wurden in einem Dokument zusammengefasst (Summary of Product Characteristics).2 PAXLOVID kann bei Therapiebeginn
innerhalb einer Woche nach Beginn der Symptome bei Patienten mit erhöhtem Risiko einen schweren Verlauf der SARS-CoV-2-Infektion verhindern.
(s. Beitrag vom 23. Dezember 2021).
* Ergänzung: PAXLOVID wurde am 28. Januar zugelassen.
1. COVID-19: EMA recommends conditional marketing authorisation for Paxlovid. 27. Januar 2022
SUMMARY OF PRODUCT CHARACTERISTICS
26. Januar 2022
Wirkung von Remdesivir, Molnupiravir und Nirmatrelvir gegen die Omikron-Variante
Drei antivirale Wirkstoffe zur Behandlung der COVID-19-Erkrankung sind verfügbar. Remdesivir zur intravenösen Therapie, die beiden anderen, Molnupiravir und Nirmatrelvir, werden als Tabletten oral eingenommen. Alle können bei frühzeitigem Therapiebeginn einen schweren Verlauf der Erkrankung verhindern. Da die klinischen Studien bereits vor einiger Zeit durchgeführt wurden, ergibt sich die Frage, ob auch die aktuell vorherrschende Variante Omikron durch die Virustatika erfasst wird. In New York wurde die Aktivität der beiden Hemmstoffe der RNA-Polymerase, Remdesivir und Molnupiravir, mit der von Nirmatrelvir, einem Proteaseinhibitor, verglichen. Dazu wurden Zellkulturen mit den Viren infiziert. Verwendet wurden HeLa-ACE2- und Vero-TMPRSS2-Zellen. In diesem In-vitro-Vergleich waren die Hemmkonzentrationen (IC90) von Nirmatrelvir gegen die Omikron-Variante am niedrigsten (0,19 µM), gefolgt von Remdesivir (2,0 µM) und EIDD-1931 (8,1 µM), dem aktiven Metaboliten des Molnupiravir. Die Unterschiede in der Aktivität gegen die verschiedenen Varianten waren für alle Substanzen gering. Für Nirmatrelvir wurden Konzentra-tionen von 0,24, 0,78 und 1,17 µM für die anderen drei Varianten Alpha, Beta und Delta ermittelt.
21. Januar 2022
Impfung verhindert MIS-C bei Jugendlichen
Bei Kindern sind Komplikationen einer SARS-CoV-2-Infektion selten. Vor allem das MIS-C („Multisystem Inflammatory Syndrome in Children“) bzw. PIMS („Pediatric Inflammatory Multisystem Syndrome“) ist eine sehr seltene, aber schwerwiegende Komplikation, die etwa zwei bis sechs Wochen nach einer leichten oder sogar asymptomatischen Infektion mit dem Virus auftreten kann. Die Symptome können variieren. Häufig bestehen Fieber, Bauchschmerzen, Übelkeit, Erbrechen, Diarrhö und Hautausschläge. Einige Kinder haben eine Myokarditis oder Niereninsuffizienz. Bei schweren Verläufen kommt es zur Hypotension und Schock. Es gibt Hinweise, dass eine Impfung vor der Komplikation schützen kann, umfangreiche Studien liegen aber bisher nicht vor. In der zweiten Hälfte des vergangenen Jahres, als die Delta-Variante vorherrschend war, wurden in 24 US-amerikanischen Kinderkliniken die Daten von 102 Patienten mit MIS-C ausgewertet. Es handelte sich um Patienten im Alter von 12 bis 18 Jahren von denen 97 (95%) nicht geimpft waren, fünf Patienten hatten zwei Dosen des Impfstoffs erhalten. Eine intensivmedizinische Behandlung war bei 61% notwendig, 37% benötigten lebensunterstützende Maßnahmen, wie eine mechanische Beatmung. Alle waren nicht geimpft. Die Zeitdauer des Krankenhausaufenthalts war mit fünf Tagen bei geimpften und ungeimpften Jugendlichen gleich. Die Auswertung bestätigt, dass die zweifache Impfung eine hohe Schutzwirkung von etwa 90% vor dem MIS-C hat und unterstützt die Empfehlung, bei Jugendlichen eine COVID-Impfung durchzuführen.
19. Januar 2022
Cefiderocol und Eisenstoffwechsel des Patienten
Das Siderophor-Cephalosporin Cefiderocol besitzt ein breites antibakterielles Spektrum gegen gramnegative Bakterien, einschließlich Carbapenem-resistente Erreger. Das ß-Laktamase-feste Antibiotikum gelangt über bakterielle Eisentransportproteine (TonB) in den periplasmatischen Raum. Da sich seine chemische Struktur von anderen Cephalosporinen durch eine eisenbindende Gruppe unterscheidet, stellt sich die Frage, ob der Eisenhaushalt des Menschen durch die Therapie beeinflusst werden könnte. Patienten mit einer nosokomialen Pneumonie, die an der APEKS-NP-Studie teilnahmen, wurden in dieser Hinsicht genauer untersucht. Sie hatten entweder dreimal täglich 2 g Cefiderocol oder Meropenem erhalten. In umfangreichen Laboruntersuchungen wurde die Eisenhomöostase überprüft. Die Konzentrationen von Hepcidin und Eisen, sowie der Gesamtbindungskapazität für Eisen und Sättigung des Transferrins wurden bestimmt. Die Veränderungen der untersuchten Parameter im Laufe der Studie waren in beiden Gruppen ähnlich. Die Rate an Anämie-bedingten unerwünschten Ereignissen lag in beiden Gruppen bei etwa 18%. Insgesamt erhielten 37 Patienten im Cefiderocolarm und 27 im Meropenemarm der Studie eine Bluttransfusion und / oder Eisen.
10. Januar 2022
Frühzeitiger Einsatz von Remdesivir verhindert schwere COVID-Verläufe
Remdesivir (VEKLURY) war 2020 das erste zur Therapie der COVID-19-Erkrankung zugelassene Arzneimittel. Da das Virustatikum intravenös verabreicht werden muss, kam es in den ersten Studien nur bei stationär behandelten Patienten mit relativ weit fortgeschrittener Erkrankung zum Einsatz. Die Therapieergebnisse mehrerer Studien waren teilweise widersprüchlich. In einer aktuellen, Placebo-kontrollierten Studie wurde untersucht, ob bei frühzeitigem Einsatz ein schwerwiegender Krankheitsverlauf verhindert werden kann. Bei allen Studienteilnehmern bestand mindestens ein Risikofaktor für einen schweren Verlauf. Bei einem Einsatz innerhalb von sieben Tagen nach Symptombeginn verhinderte eine ambulante, dreitägige intravenöse Behandlung mit Remdesivir einen Verlauf der SARS-CoV-2-Infektion, der eine stationäre Therapie erfordern würde. Im Vergleich zu einer Placebogabe wurde das Risiko durch Remdesivir um 87% reduziert (0,7% vs 5,3%). In beiden Gruppen gab es keinen tödlichen Verlauf. Die Verträglichkeit des antiviralen Arzneimittels war gut, relevante Unterschiede zum Placebo wurden nicht beobachtet.